研究紹介
プロジェクト(4)
精子幹細胞の老化とDNA修復機構の解明
幹細胞は一般に無限に増殖することができると考えられてきましたが、血液幹細胞や神経幹細胞はごく短期間だけ増殖し、自己複製能を喪失してしまいます。そのため、胎児由来のES細胞と異なり生後の幹細胞に本当に無限の増職能があるかどうかは長い間分かりませんでした。しかし、私たちが樹立したGS細胞は2年以上の長期にわたり幹細胞を保ったまま増殖することができるのみならず、正常な子孫を作成しました(Kanatsu-Shinohara M. et al., Development 2005;132:4155-4163)。また精子幹細胞は継代移植を行うことで生体内で3年以上も自己複製が可能です (Ryu BY. et al., Stem Cells 2006;24:1505-1511) 。
これらの結果は精子幹細胞が文字通り「無限の命」をもつ幹細胞であることを示唆しますが、一体どのようなメカニズムで精子幹細胞の老化が制御されているのかについてはほとんど分かっていません。無限の命があるにも関わらず、放射線照射などのダメージを受けると精子幹細胞は細胞死を起こしやすく (Ishii K. et al., Stem Cell Reports 2014;3:676-689)、この細胞には子孫にきれいなゲノムを伝達するための特別な仕組みがあるのではないかと想像しています。これは放射線照射を行っても細胞周期が止まらないES細胞とは対照的です。私たちは長期培養したGS細胞と老化マウスモデルを用いることで精子幹細胞にはなぜ寿命がないのか、どのようにゲノムを維持しているのかを解析しています。
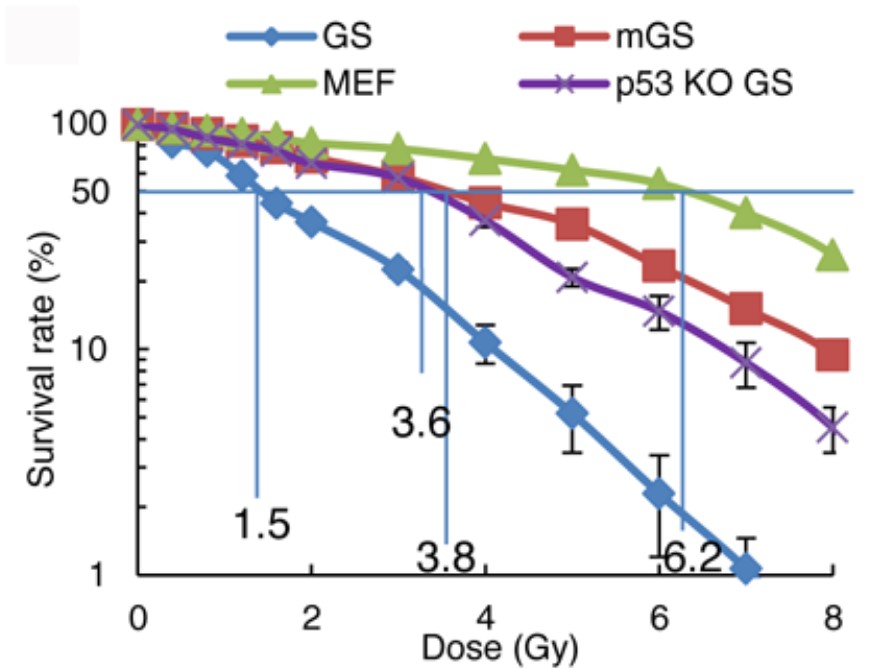
(図の説明)GS細胞は体細胞やmGS細胞(ES細胞もほぼ同じ挙動を示します)よりも放射線に対して容易にp53依存性の細胞死を起こすにも関わらず、どの細胞よりも長期間安定して分裂できる。