PD-1プロジェクト
メンバー
2023/06/02
PD-1(Programmed cell death 1)は、T細胞の細胞死誘導時に発現が増強される遺伝子として1992年に当研究室メンバーであった石田博士らによって
単離・同定された。しかし、その機能は長い間不明であった。1998年に作製されたPD-1欠損マウスが脾腫、血中免疫グロブリンの増加、脾B細胞の抗IgM刺激
に対する反応性亢進等を来したことから、 PD-1は生体内において免疫反応を負に制御している事が明らかとなった。PD-1欠損マウスが発症する
自己免疫疾患は、マウスの系統により病態が異なり、C57BL/6系統では SLE様の腎炎・関節炎を発症し、BALB/c系統では拡張型心筋症を発症する。
これらのモデルを用いて、PD-1による自己免疫疾患の発症の解析を行っている。またPD-1シグナルを制御することで免疫応答をコントロールし、
自己免疫病を治療する方法の開発もおこなっている。
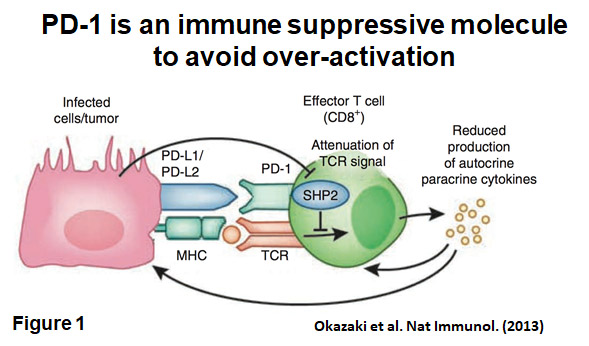
当研究室では、自己免疫と密接な関係にある腫瘍免疫の研究も行っている。腫瘍は、従来自己組織の一部とみなされてきた。そのため、自己と非自己
の判別がつかず、免疫は腫瘍を拒絶できないと考えられる。しかし、PD-1欠損マウスで自己免疫が発症するという事実は、PD-1シグナルをブロックすることで、
癌を攻撃できる可能性を示している。この仮説に基づき、我々は、腫瘍細胞がPD-L1を発現し、 免疫監視から逃避していることを明らかにしてきた。
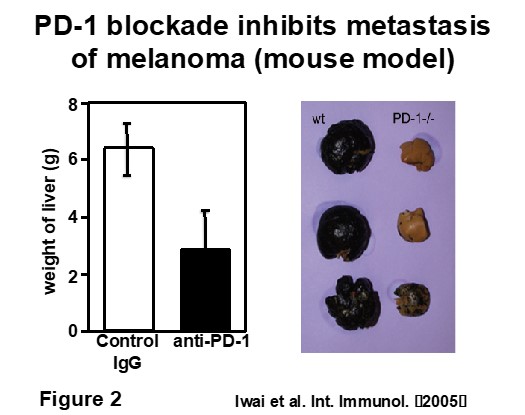
ヒトにおいても予後の悪い癌患者の癌は、予後の良い患者よりもPD-L1の発現が高かった。PD-1抗体、もしくはPD-L1抗体を担癌マウスに投与すると、
抑制シグナルの解除と共にT細胞が活性化され、腫瘍増殖や、転移を抑制することができた(図)。
これらの成果を基に、当研究室では世界に先駆けPD-1抗体を用いた癌免疫治療法を提唱してきた。2014年7月には国内外で初めてPD-1抗体が悪性黒色腫の
治療薬として認可され、現在では世界各地でPD-1抗体を用いた臨床試験が行われるに至っている。当研究室でも、他の癌腫について京大、他大学の医学部と
共同研究を行い、臨床試験を実施している。従来の免疫治療法と比較すると、PD-1抗体治療単独の奏功率は20-30%、がん腫によってはCTLA-4抗体との併用治療で、奏功率は50-60%と劇的に向上した。
しかし、なぜ残りの患者はPD-1抗体治療に不応答なのか、まだほとんどわかっていない。PD-1抗体治療のメカニズム解明を進めることで治療効果を増強
させることができると思われる。またPD-1抗体応答性の患者と不応答性の患者を見分けるバイオマーカー開発も重要である。これらの目的のため、
臨床サンプルとマウスモデルを駆使し、PD-1阻害時における応答性、不応答性のメカニズム解明と、PD-1抗体治療効果予測バイオマーカー探索を行っている。
最近では、PD-1を介した免疫反応が、代謝と深く関与しており、生命の根幹的な恒常性の維持に重要であることもわかってきた。
今後は、免疫・代謝を融合した新しい視点からも、生命現象の原理を理解していく。
当研究室では分子生物学的、免疫学的実験手法と生命体の思想を学び、生命を全体像として捉える力を備えた自立した研究者を育てることを目標としている。
世界の第一線で活躍し、免疫現象の根源的な問題に取り組もうとする志の高い学生やポスドクを随時募集している。
[代表的な論文]
1. Chamoto K, Yaguchi T, Tajima M, Honjo T.Insights from 30-year journey: function, regulation and therapeutic modulation of PD1. (2023) Nat Rev Immnol. in press.
2. Kawakami H, Sunakawa Y, Inoue E, Matoba R, Noda K, Sato T, Suminaka C, Yamaki M, Sakamoto Y, Kawabata R, Ishiguro A, Akamaru Y, Kito Y, Yabusaki H, Matsuyama J, Takahashi M, Makiyama A, Hayashi H, Chamoto K, Honjo T, Nakagawa K, Ichikawa W, Fujii M.
Soluble programmed cell death ligand 1 predicts prognosis for gastric cancer patients treated with nivolumab: Blood-based biomarker analysis for the DELIVER trial. (2023) Eur J Cancer. (184):10-20.
3. Tanaka K*, Chamoto K*(*equally corresponding), Saeki S, Hatae R, Ikematsu Y, Sakai K, Ando N, Sonomura K, Kojima S, Taketsuna M, Kim YH, Yoshida H, Ozasa H, Sakamori Y, Hirano T, Matsuda F, Hirai T, Nishio K, Sakagami T, Fukushima M, Nakanishi Y, Honjo T, Okamoto I.
Combination bezafibrate and nivolumab treatment of patients with advanced non-small cell lung cancer. (2022) Sci Transl Med. 14 (675): eabq0021.
4. Matsushima S, Ajiro M, Iida K, Chamoto K, Honjo T, Hagiwara M.
Chemical induction of splice-neoantigens attenuates tumor growth (2022) Sci Transl Med. 14 (673): eabq6056.
5. Al-Habsi M*, Chamoto K*, Matsumoto K*, Nomura N*(*equally contributed), Zhang B, Sugiura Y, Sonomura K, Maharani A, Nakajima Y, Wu Y, Nomura Y, Menzies R, Tajima M, Kitaoka K, Haku Y, Delghandi S, Yurimoto K, Matsuda F, Iwata S, Ogura T, Fagarasan S, Honjo T.
Spermidine activates mitochondrial trifunctional protein and improves antitumor immunity in mice. (2022) Science. 28; 378 (6618): eabj3510. Highlighted by Cancer Discovery:[PubMed]
6. Zhang B, Vogelzang A, Miyajima M, Sugiura Y, Wu Y, Chamoto K, Nakano R, Hatae R, Menzies RJ, Sonomura K, Hojo N, Ogawa T, Kobayashi W, Tsutsui Y, Yamamoto S, Maruya M, Narushima S, Suzuki K, Sugiya H, Murakami K, Hashimoto M, Ueno H, Kobayashi T, Ito K, Hirano T, Shiroguchi K, Matsuda F, Suematsu M, Honjo T, Fagarasan S.
B cell-derived GABA elicits IL-10+ macrophages to limit anti-tumour immunity. (2021) Nature, 599(7885):471-476.
7. Ogishi M, Yang R, Aytekin C, Langlais D, Bourgey M, Khan T, Ali FA, Rahman M, Delmonte OM, Chrabieh M, Zhang P, Gruber C, Pelham SJ, Spaan AN, Rosain J, Lei WT, Drutman S, Hellmann MD, Callahan MK, Adamow M, Wong P, Wolchok JD, Rao G, Ma CS, Nakajima Y, Yaguchi T, Chamoto K, Williams SC, Emile JF, Rozenberg F, Glickman MS, Rapaport F, Kerner G, Allington G, Tezcan I, Cagdas D, Hosnut FO, Dogu F, Ikinciogullari A, Rao VK, Kainulainen L, Beziat V, Bustamante J, Vilarinho S, Lifton RP, Boisson B, Abel L, Bogunovic D, Marr N, Notarangelo LD, Tangye SG, Honjo T, Gros P, Boisson-Dupuis S, Casanova JL.
Inherited PD-1 deficiency underlies tuberculosis and autoimmunity in a child. (2021) Nat Med.27(9):1646-1654.
8. Nakajima Y, Chamoto K, Oura T, and Honjo T.
Critical role of the CD44lowCD62Llow CD8+ T-cell subset in restoring anti-tumor immunity in aged mice. (2021) Proc Natl Acad Sci U S A, 118:e2103730118.
9. Kumar A and Chamoto K.
Immune metabolism in PD-1 blockade-based cancer immunotherapy. (2021) Int Immunol, 33: 17-26, review. [PubMed]
10. Akrami M*, Menzies R*, Chamoto K* (*equally contributed), Miyajima M, Suzuki R, Sato H, Nishii A, Tomura M, Fagarasan S, Honjo T.
Circulation of gut-preactivated naive CD8+ T cells enhances antitumor immunity in B cell-defective mice. (2020) Proc Natl Acad Sci U S A. 117(38):23674-23683. [PubMed]
11. Kumar A*, Chamoto K* (*equally contributed), Chowdhury PS, Honjo T.
Tumors attenuating the mitochondrial activity in T cells escape from PD-1 blockade therapy. (2020) Elife. 9, e52330. [PubMed]
12. Chamoto K, Hatae R, Honjo T.
Current issues and perspectives in PD-1 blockade cancer immunotherapy. (2020) Int J Clin Oncol., 25:790-800. [PubMed]
13. Hatae R*, Chamoto K*(*equally contributed), Kim YH, Sonomura K, Taneishi K, Kawaguchi S, Yoshida H, Ozasa H, Sakamori Y, Akrami M, Fagarasan S, Masuda I, Okuno Y, Matsuda F, Hirai T, Honjo H.
Combination of host immune metabolic biomarkers for the PD-1 blockade cancer immunotherapy (2019) JCI insight, 5, e133501. [PubMed]
14. Goto M*, Chamoto K* (*equally contributed), Higuchi K, Yamashita S, Noda K, Iino T, Miura M, Yamasaki T, Ogawa O, Sonobe M, Date H, Hamanishi J, Mandai M, Tanaka Y, Chikuma S, Hatae R, Muto M, Minamiguchi S, Minato N, Honjo T.
Analytical performance of a new automated chemiluminescent magnetic immunoassays for soluble PD-1, PD-L1, and CTLA-4 in human plasma. (2019) Sci Rep. 9:10144. [PubMed]
15. Mulati K, Hamanishi J, Matsumura N, Chamoto K, Mise N, Abiko K, Baba T, Yamaguchi K, Horikawa N, Murakami R, Taki M, Budiman K, Zeng X, Hosoe Y, Azuma M, Konishi I, Mandai M.
VISTA expressed in tumour cells regulates T cell function. (2019) Br J Cancer. 120:115-127. [PubMed]
16. Chowdhury PS*, Chamoto K* (*equally contributed), Kumar A, Honjo T.
PPAR-induced fatty acid oxidation in T cells increases the number of tumor-reactive CD8+ T cells and facilitates anti-PD-1 therapy. (2018) Cancer Immunol Res, 6: 1375-1387. [PubMed]
17. Chowdhury PS*, Chamoto K* (*equally contributed), Honjo T.
Combination therapy strategies for improving PD-1 blockade efficacy: A new era in cancer immunotherapy.
J Intern Med. 283:110-120 (2018)[PubMed]
18. Miyajima M, Zhang B, Sugiura Y, Sonomura K, Guerrini MM, Tsutsui Y, Maruya M, Vogelzang A, Chamoto K, Honda K, Hikida T, Ito S, Qin H, Sanuki R, Suzuki K, Furukawa T, Ishihama Y, Matsuda F, Suematsu M, Honjo T, Fagarasan S.
Metabolic shift induced by systemic activation of T cells in PD-1-deficient mice perturbs brain monoamines and emotional behavior.
Nat Immunol. 18:1342-1352 (2017)[PubMed]
19. Chamoto K*, Muna Al-Habsi* (*equally contributed), Honjo T.
Role of PD-1 in immunity and diseases.
Curr Top Microbiol Immunol, 198:3757. (2017)[PubMed]
20. Iwai Y*, Hamanishi J*, Chamoto K* (*equally contributed), Honjo T.
Cancer immunotherapies targeting the PD-1 signaling pathway.
J Biomed Sci. 24:26. Review (2017)[PubMed]
21. Chamoto K, Chowdhury PS, Kumar A, Sonomura K, Matsuda F, Fagarasan S, Honjo T.
Mitochondrial activation chemicals synergize with surface receptor PD-1 blockade for T cell-dependent antitumor activity.
Proc Natl Acad Sci U S A. 114: E761-E770. (2017)[PubMed]
22. Okazaki T, Chikuma S, Iwai Y, Fagarasan S, Honjo T.
A rheostat for immune responses: the unique properties of PD-1 and their advantages for clinical application.
Nat Immunol. 14(12):1212-8 Review (2013) [PubMed]
23. Chikuma S, Suita N, Okazaki IM, Shibayama S, Honjo T.
TRIM28 prevents autoinflammatory T cell development in vivo.
Nat Immunol. 13(6):596-603 (2012) [PubMed]
24. Hamanishi J, Mandai M, Iwasaki M, Okazaki T, Tanaka Y, Yamaguchi K, Higuchi T, Yagi H, Takakura K, Minato N, Honjo T, Fujii S.
Programmed cell death 1 ligand 1 and tumor-infiltrating CD8+ T lymphocytes are prognostic factors of human ovarian cancer.
PNAS. 104(9):3360-5 (2007) [PubMed]
25. Okazaki T, Honjo T.
Rejuvenating exhausted T cells during chronic viral infection.
Cell. 124(3):459-61 (2006) [PubMed]
26. Iwai Y, Terawaki S, Ikegawa M, Okazaki T, Honjo T.
PD-1 inhibits antiviral immunity at the effector phase in the liver.
J Exp Med. ;198(1):39-50 (2003). [PubMed]
27. Okazaki, T., Tanaka, Y., Nishio, R., Mitsuiye, T., Mizoguchi, A., Wang, J., Ishida, M., Hiai, H., Matsumori, A., Minato, N., and Honjo, T.
Autoantibodies against cardiac troponin I are responsible for dilated cardiomyopathy in PD-1-deficient mice.
Nat Med. 9(12):1477-83 (2003) [PubMed]
28. Iwai, Y., Ishida, M., Tanaka, Y., Okazaki, T., Honjo, T., and Minato N.
Involvement of PD-L1 on tumor cells in the escape from host immune system and tumor immunotherapy by PD-L1 blockade.
PNAS 99, 12293-7 (2002) [PubMed]
29. Nishimura H, Okazaki T, Tanaka Y, Nakatani K, Hara M, Matsumori A, Sasayama S, Mizoguchi A, Hiai H, Minato N, Honjo T.
Autoimmune dilated cardiomyopathy in PD-1 receptor-deficient mice.
Science 291(5502):319-22 (2001) [PubMed]